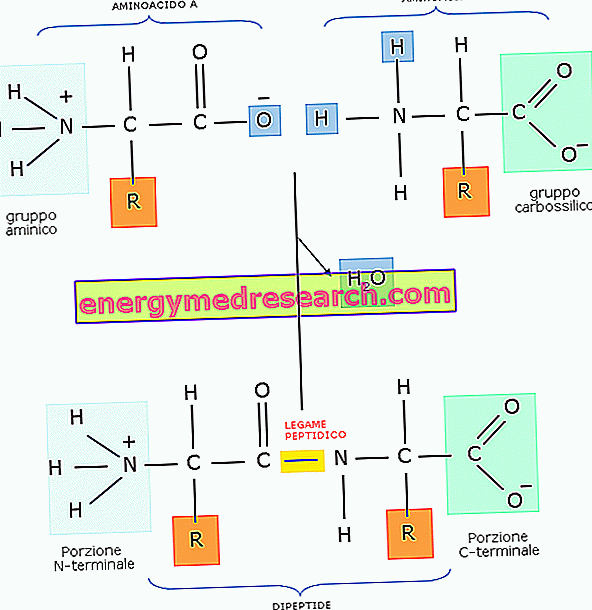
Peptidinė jungtis yra kovalentinė jungtis, sukurta tarp dviejų molekulių, kai karboksilo grupė reaguoja su kitos amino grupe per kondensaciją (arba dehidrataciją, kuri veda - tai yra vandens molekulės pašalinimą). ).
Paprastai peptidinė jungtis susidaro tarp dviejų aminorūgščių, kilusių iš dipeptido.
Kadangi jo molekulėje dipeptidas vis dar turi amino grupę ir karboksilo grupę, jis gali sudaryti peptido ryšį su trečiąja aminorūgštimi, kurios kilmės šalis yra tripeptidas, ir pan. Kai aminorūgščių skaičius yra santykinai mažas, tai vadinama oligopeptidu, o jei amino rūgščių skaičius padidėja, tai vadinama polipeptidu arba baltymu.
Iš tikrųjų, nepaisant skaičiaus, peptidų jungtis nėra paprasto tipo, bet 60% sudaro vienintelę klijavimo prigimtį ir 40% dvigubą ryšį.
Gyvuose organizmuose peptidinės jungties susidarymą katalizuoja fermentas, vadinamas peptidilo transferaze, esantis pagrindinėje ribosomų subvienetoje.
Be to, į maistą įvesti baltymai yra aminorūgščių grandinės, sujungtos su peptidinėmis jungtimis. Virškinimo metu šios jungtys yra suskirstytos į tam tikrus fermentus (peptidazes), esančius skrandžio ir kasos sultyse. Atskiros žarnyno absorbuotos aminorūgštys praeina iš kraujo ir yra užfiksuotos ląstelėse, ypač kepenyse, kurios sujungia jas per naujas peptidines jungtis, kad susidarytų jiems reikalingi baltymai (ne tik struktūriniai, bet ir hormoniniai, fermentiniai ir pan.). .). Tiesą sakant, iš tikrųjų yra daug baltymų, turinčių skirtingų fizikinių ir cheminių savybių, kurios kyla iš skirtingų 20 paprastųjų aminorūgščių savybių ir nuo to, kaip jie yra sujungti polipeptidinėje grandinėje. Pakanka pasakyti, kad 100 aminorūgščių baltymų, todėl santykinai mažas, gali sudaryti 20100 = 1, 27 x 10130 galimų polipeptidinių grandinių. Tinkamos aminorūgščių grandinės kūrimo instrukcijos yra uždarytos individo genome.



